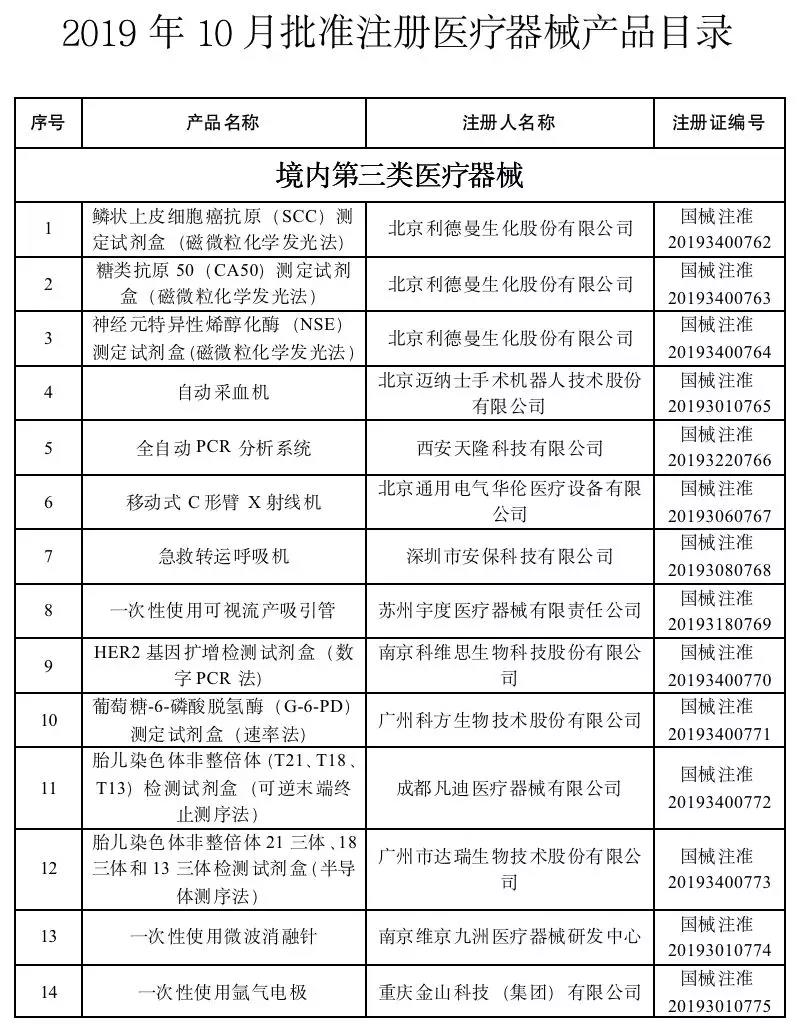
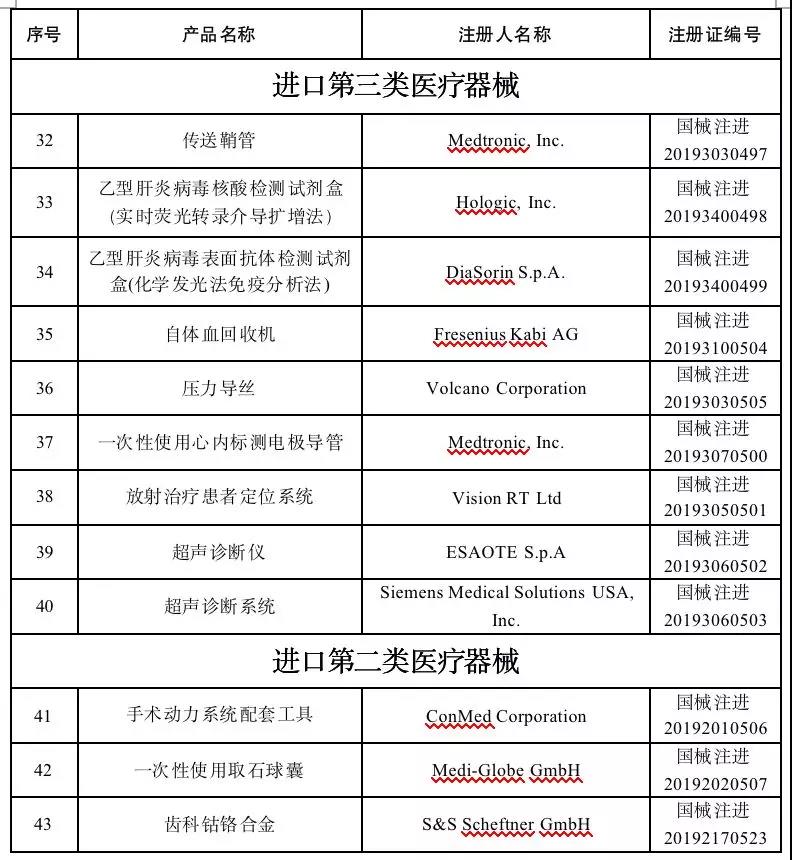
11月25日,国家药监局消息,发布了关于批准注册43个医疗器械产品的公告(2019年第96号)。
除此之外,国家药监局对创新性医疗器械也一直大力扶持。
国家药监局贯彻落实《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号)和《中央办公厅国务院办公厅关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),深入推进医疗器械审评审批制度改革,加速医疗器械创新发展。
自《创新医疗器械特别审批程序》发布以来,截止2018年12月31日,已有197个产品进入创新医疗器械特别审查通道,批准神经外科手术导航定位系统、正电子发射断层扫描及磁共振成像系统等54个产品注册,一批创新性强、技术含量高、临床需求迫切的创新产品上市,填补了相关领域的空白,更好的满足了人民群众的健康需求。
据统计,对创新优先平均审评审批时间较其他普通三类首次注册产品平均压缩83天,创新产品从研发到上市的时间进一步缩短。
修订后的程序设置更科学合理,有利于进一步集中力量,提高效率,促进医疗器械产业创新发展。