200亿大品种,进入中国市场。
▍200亿品种,获批
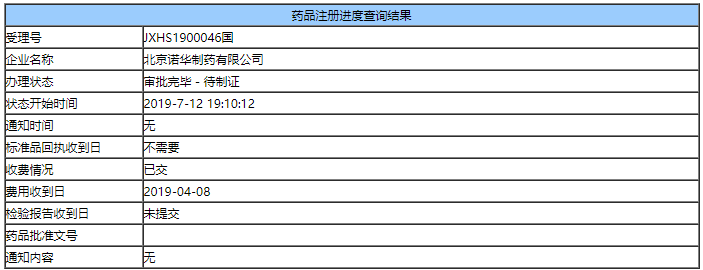
今日(7月15日),据insight数据库消息,诺华多发性硬化药“芬戈莫德”在国内的上市申请审批状态变更为“审批完毕-待制证”,这个200亿市场的大品种,已获药监局批准上市。
(图片来源:insight数据库)
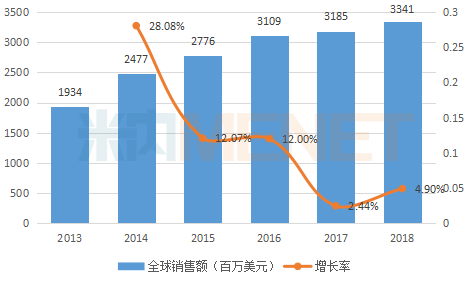
公开资料显示,芬戈莫徳是诺华和日本三菱制药共同研发的全球首个可口服给药治疗多发性硬化症(简称MS)的药物,最早于2010年9月在FDA上市。据米内网数据,自上市以来,芬戈莫徳在全球的销售额呈现稳步上升趋势,2018年全球销售额达33.41亿美元(折合人民币206.86亿元)。
(图片来源:米内网)
2018年8月,盐酸芬戈莫徳胶囊被列入CDE发布的48个境外已上市临床急需新药名单。据了解,名单中的48个产品重点考虑近年来美国、欧盟或日本批准上市,我国尚未上市的用于罕见病治疗的新药,以及用于防治严重危及生命或严重影响生活质量的疾病,且尚无有效治疗手段或具有明显临床优势的新药,国家药监局将按照优先审评审批程序,加快审评审批。
2019年4月,诺华以进口5.1类提交的盐酸芬戈莫徳胶囊上市申请获得CDE承办受理,7月3日审评完毕,进入审批状态。
从2018年进入境外已上市临床急需新药名单,再到7月获批,诺华的芬戈莫徳可谓是进展迅速。
▍诺华产品,市场已近天花板
我国首部《多发性硬化患者生存报告(2018)》显示,多发性硬化症作为罕见病的一种,是严重、终身、进行性、致残性的中枢神经系统疾病,多发于青壮年,全世界有2000多万患者,我国预计约有3万名患者——但误诊率和未发现率都较高。
多发性硬化症分为复发缓解型(RRMS,占比约85%)、原发进展型(PPMS 10%)和进展复发型(PRMS, 罕见型5%)。
诺华的芬戈莫徳是首个S1P1R靶点药物,靶点作用机制新颖,有较好的潜力,目前获批适应症有多发性硬化症(MS)、复发缓解型多发性硬化症(RRMS)。
但业内普遍预测,因为专利即将到期,诺华的市场业绩趋于稳定,已基本接近天花板。
罗氏的Ocrevus,已获批用于原发进展型和复发缓解型多发性硬化症,首个获批用于原发进展型,未来有较大的市场增长空间——其在2017年3月上市,当年销售额就已达到8.95亿美元,2018年销售额23.53亿瑞士法郎(约24亿美元)。
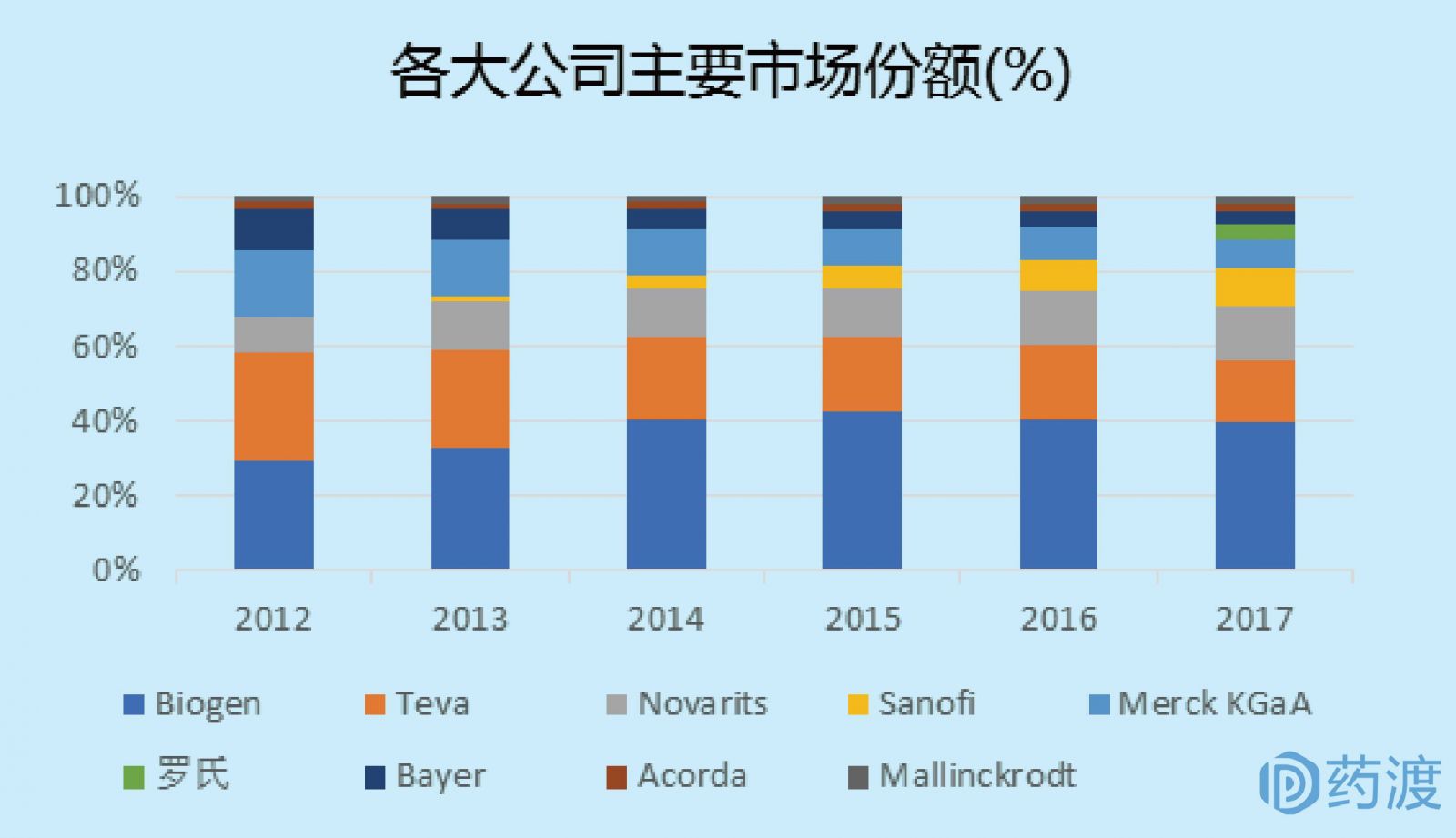
药渡数据显示,在各大药企的竞争格局中,未来预计诺华、梯瓦、赛诺菲会保持市场稳定,百健依然维持霸主地位,拜耳和默多克继续缩减市场份额,罗氏的产品继续市场放量,或将攀升至3-4位。
(图片来源:药渡)
虽然诺华的销量已经基本接近天花板,但其进入中国市场后,还会有多少的市场增量,这点需要等待时间的验证。
▍国内药企,加码布局
据了解,目前中国只有两款MS药物获批上市,分别为干扰素β-1a及特立氟胺,其中,我国罕见病用药注射用重组人干扰素β-1b(倍泰龙)以28.9%的降幅进入医保,但有媒体报道,因为药占比的限制,倍泰龙进入医保后,依然在医院难觅踪迹,患者仍然要去药店自费购买。因此,倍泰龙在中国的销售业绩并不理想。
因此,MS仍有市场尚未开掘。
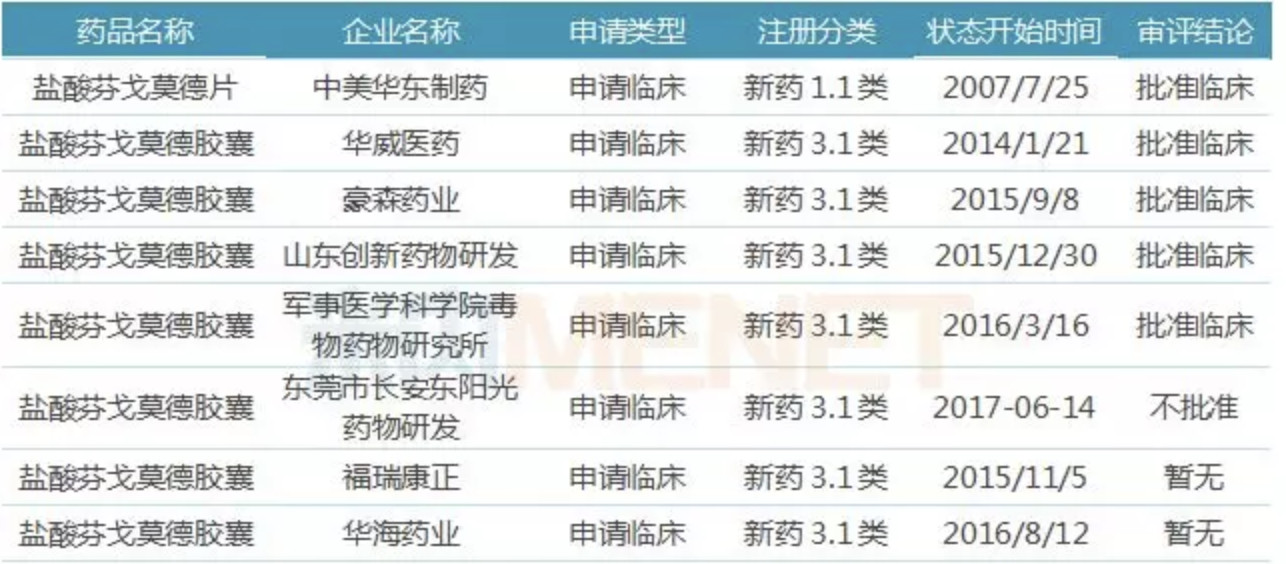
据米内网数据,在原研厂家还未获批时,国内药企就已开始布局盐酸芬戈莫徳。2007年,中美华东制药的盐酸芬戈莫徳片以新药1.1类申请,目前以批准临床。剩余的华威医药、豪森药业等7家企业的盐酸芬戈莫徳胶囊以新药3.1类申请,其中,4家企业获批临床。