4月13日讯
一品种,断供一年
近日,武田制药在致甲状旁腺功能减退症协会、更广泛的甲状旁腺功能减退症患者和医疗界的公开信中宣布,Natpara 100微克(mcg)的供应中断最早可能从4月5日这周开始,并持续约一年。
“作为我们严格的质量和制造流程的一部分,这次供货的延误,影响了NATPARA 100-mcg的制造和发布,”该公司美国医疗事务负责人Tom Koutsavlis和美国罕见病负责人Cheryl Schwartz表示。
资料显示,武田公司已经通过公司的特殊用途计划(SUP)通知了目前正在接受Natpara治疗的患者以及他们的医生。使用SUP的25 mcg,50 mcg和75 mcg注射剂量的患者不会受到影响。
尽管武田没有具体说明造成中断的原因,只是表示其会影响后续生产,但武田制药认为,该问题与2019年美国Natpara召回事件无关。该公司表示:“尽管在导致美国召回的最初问题上取得了进展,但在将Natpara带回美国更广泛的患者群体方面,我们仍然面临着复杂的挑战。”
除了召回事件之外,制造延误已经推迟了公司此前制定的时间表,而武田表示,预计不会在2022年3月31日之前恢复上市。
据了解,Natpara注射液是一种重组人蛋白,具有内源性甲状旁腺激素(PTH)的全长84个氨基酸序列,目前在美国被批准为慢性甲状旁腺功能减退症成人患者的唯一辅助治疗药物。FDA于2015年批准了将Natpara以及钙和维生素D一起用于甲状旁腺功能减退症的治疗。
此前有过召回行为
2019年,该公司召回了所有美国Natpara的剂量产品,原因是担心进样器筒的橡胶套或隔垫产生的颗粒可能掉入进样器中。武田表示,当在14天的治疗期内反复刺穿覆盖物时,小的橡胶碎片可能会进入药筒。
因为上述召回,使用Natpara产品的患者几乎立刻受到了影响。据悉,甲状腺功能减退症是一种罕见的消耗钙的疾病,在美国大约有70000人患病,召回前有约2800人依靠Natpara进行治疗。她补充说,到2021年3月底,武田的特殊用途计划招募了400多名患者。
当时,Natpara的用户聚集在Facebook上讨论他们的选择,并担心尽管武田公司(Takeda)确信正在解决该问题,但这个药物可能永远不会重返市场。据报道,在2018年,Natpara在美国的最新全年销售额中,赚了2.3亿美元。
与此同时,在2019年11月对Hikari工厂的检查中,调查人员还查明了一块发生故障的无菌设备,这导致了多个批次的生产中的产品被拒收。尽管武田对故障机器进行了“多次调查”,但后来的测试却发现了同样的问题。武田发言人当时对Fierce Pharma表示,Natpara不是在光化学工厂生产的。
某种程度上,这款断供的药物是一款罕见病用药。?罕见?,就是它的原罪。价格高昂的罕见病药品面临上市难、支付难的问题,而价格过低的药品则面临断供甚至停产危机;对Natpara来说,因为生产企业较少,一旦企业生产发生问题,就会断供。
?罕见?,或是原罪
对企业来说,因为罕见病药物产品的售价低,市场规模较小,企业生产积极性不高;此外,因为药物生产且供应的企业少,容易出现供应不及时、供应不足的问题。
这点在国内也表现明显:治疗全身型重症肌无力(Generalized Myasthenia Gravis,简称 gMG)的药品溴吡斯的明,曾经发生过多次断供事件。2015年,该品种因中标价格过低在浙江省弃标,2016年因为溶出度存在波动,部分产品被召回,最终导致了全国范围的药物短缺。2017年,因为药企的生产基地搬迁,该品种又停产了4个月,导致产品断供问题。
《2019中国罕见病药物可及性报告》显示,罕见病药物市场是一个市场失灵的领域,从研发、生产到定价和准入,市场都无法提供足够的激励机制为企业提供发展动力。因为与其他疾病药物相比,罕见病药物的研发过程更为艰辛,患者人数少,临床试验难度更高。在没有可观利益驱动的情况下,企业通常不愿意投入巨大的成本用于新药的研发和生产。
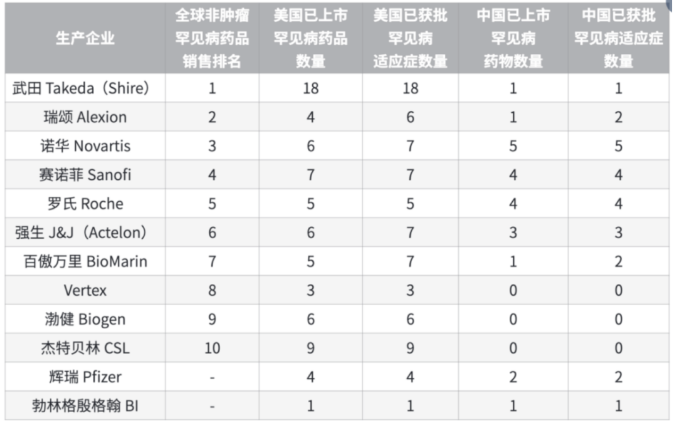
作为全球领先的罕见病药物生产巨头,武田制药此次断供则是上述现象的典型缩影。按照全球罕见病药品销售排名来看,因为成功收购夏尔,武田排名第一,其次是瑞颂、诺华、赛诺菲、罗氏位列前五名。